Точка принятия решений 1: производство
Точка принятия решений 1: производство
Производство фармацевтической продукции требует строгого соблюдения стандартов надлежащей практики организации производства (good manufacturing practice – GMP) для того, чтобы «продукты производились и контролировались в соответствии со стандартами качества, отвечающими предполагаемому использованию и требованиям регистрационного удостоверения» (WHO, 2003). GMP – термин, определение которого имеется в законах многих стран, он описывает набор принципов и процедур обеспечения качества, которые необходимо соблюдать производителям лекарственных средств для получения продукции соответствующего качества. По данным ВОЗ, соблюдение GMP помогает снизить риски, свойственные фармацевтической продукции, в частности риск перекрестного загрязнения (в том числе непредвиденными контаминантами) и путаницы, вызванной, например, наклеиванием на контейнеры не тех этикеток. Если эти стандарты не выполняются по всему производственному процессу, включая работу с сырьем, хранение, упаковку и этикетирование, появляется риск производства некачественных лекарств. Там, где такие стандарты четко не определены, несовершенны или плохо исполняются, риск попадания в обращение фальсифицированных или не соответствующих стандартам лекарств повышается.
Поддельными или фальсифицированными называют лекарства, намеренно изготовленные так, чтобы выглядеть как оригинальный продукт, и, следовательно, нарушающие права на торговую марку или патенты. Рынок фальсифицированных лекарств растет по всему миру. По прогнозам Центра лекарств в общественных интересах, к 2010 г. мировой рынок фальсифицированных лекарств вырастет более чем на 90 % и годовой объем продаж достигнет $75 млрд (Pitts, 2005). В США и Европе производству фальсифицированных лекарств способствует их продажа через Интернет. Такие продажи обходят стандартные системы надзора и неэффективно контролируются (Satchwell, 2004). Хотя фальсифицированные лекарства внешне зачастую невозможно отличить от настоящих, они могут не оказывать нужного клинического воздействия и даже быть небезопасными для здоровья в результате недостаточного количества активных фармацевтических ингредиентов или их отсутствия.
Не соответствующие стандартам или фальсифицированные лекарства могут привести к ухудшению здоровья, а иногда и к смерти. Один из наиболее трагических случаев произошел в 1995 г. на Гаити, где 89 человек умерло после употребления сиропа от кашля с парацетамолом, изготовленного с применением диэтиленгликоля – токсичного вещества, применяемого в качестве антифриза. Особое беспокойство вызывают не соответствующие стандартам антибиотики и противомалярийные средства с пониженным содержанием активного вещества, поскольку возбудители болезни могут быстрее выработать устойчивость к ним. Одно из исследований, проведенных в Юго-Восточной Азии, показало, что 38 % лекарств, продаваемых под видом противомалярийного средства на основе артезуната, не содержали достаточного количества действующего вещества или не содержали его совсем, что потенциально усиливает устойчивость возбудителя (Newton and others, 2001). Беспокойство, вызванное растущей устойчивостью возбудителей к противомалярийным средствам в районе реки Меконг в Азии, вынудило правительства активизировать деятельность, направленную на выявление фальсифицированных лекарств и уменьшение уровня сопротивляемости малярийного паразита (пример 1.2). Фальсифицированные и не соответствующие стандартам лекарства также наносят ущерб рынку законно произведенных качественных лекарств, уменьшая их конкурентоспособность на поле с равными условиями.
Пример 1.2. Борьба с подделками в районе реки Меконг, направленная на уменьшение уровня устойчивости к противомалярийным средствам
В 2003 г. программа фармакопеи США «Качество лекарств и информация», Агентство международного развития, ВОЗ, а также государственные и местные власти азиатских стран начали мониторинг качества противомалярийных средств, используемых в районе реки Меконг (Камбоджа, Лаосская Народно-Демократическая Республика, Таиланд, Вьетнам и китайская провинция Юньнань), и обучение персонала на местах навыкам тестирования лекарств. В течение первого года качество распространяемых противомалярийных лекарств (артезунат, хинин, хлорохин, сульфадоксин-пираметамин) проверялось с помощью основных тестов: визуального осмотра, растворения и тонкослойной хроматографии. В результате анализа фальсифицированные или не соответствующие стандартам противомалярийные лекарства были обнаружены во всех странах. По меньшей мере в двух странах 50 % исследованных образцов не имели информации о производителе или сроке годности. Органы контроля за лекарственными средствами во всех перечисленных странах предприняли меры по решению этих проблем. В частности, была улучшена коммуникация между региональными системами мониторинга, с одной стороны, и местными и государственными властями – с другой, что позволило быстрее оповещать о появлении поддельных лекарств и изымать их из аптек.
Источник: U.S. Pharmacopeial Convention Inc. (2005).
Для более строго соблюдения требований GMP можно предпринять несколько шагов. Во-первых, стандарты GMP должны быть кодифицированы, а последствия их невыполнения установлены в законодательном порядке. Во многих странах до сих пор отсутствует юридическое определение или обязательность применения GMP. Во-вторых, можно принять международные стандарты GMP. В настоящее время требования GMP различаются в разных странах и даже в разных агентствах, следящих за их применением. Даже определения GMP, используемые ВОЗ, ЕС и Администрацией по контролю за продуктами питания и лекарствами США, в некоторой мере различны. Такие различия могут приводить к непредвиденным отрицательным последствиям (пример 1.3).
Пример 1.3. Различия в требованиях GMP могут иметь непредвиденные последствия: Индия
В Индии действующие стандарты контроля для производства определены в правовом документе под названием Schedule M. Хотя ввод в действие Schedule M несколько раз откладывался (с конца 2002 до середины 2005 г.), это был значительный прогресс для Индии. Тем не менее изложенные в нем требования отличаются от стандартов GMP, рекомендованных ВОЗ. Индийский суд постановил, что Schedule M – законный стандарт, который должны соблюдать все производители, желающие участвовать в конкурсах на государственные закупки. Это постановление создало проблему и своего рода тупиковую ситуацию для закупок лекарств от ВИЧ/СПИД, малярии и т. п., производство которых финансируется международными организациями и некоторыми правительствами для распространения в бедных странах. Такие организации обычно требуют, чтобы на их средства закупались лекарства, соответствующие стандартам GMP, установленным ВОЗ.
Помимо прочего, тот факт, что Schedule M менее жесткий, чем GMP в США и Европе, не идет на пользу растущей индийской фармацевтической промышленности. Некоторые ведущие индийские производители лекарств, в том числе производственные предприятия, одобренные Администрацией по контролю за продуктами питания и лекарствами США, приняли более высокие стандарты контроля, чем требует Schedule M. Хотя эти ведущие индийские производители выпускают лекарства международного качества, само существование менее жестких стандартов Schedule M и то, что некоторые индийские производители руководствуются ими, может отрицательно сказаться на репутации индийской фармацевтической промышленности в целом. Принятие стандартов GMP в Индии подняло бы качество отрасли в целом и было бы выгодно для ее экспортеров.
Даже если в стране имеются четкие законодательно оформленные стандарты GMP, многое зависит от способности обеспечить их соблюдение. Таким образом, второй шаг – создание надежной системы контроля соблюдения этих стандартов. В некоторых странах эффективными оказались регулярные и выборочные проверки не только производственных помещений, но и лекарств на различных стадиях процесса – от производства или импорта до розничной продажи. На основании исследований, проведенных в Мьянме и Вьетнаме, ВОЗ полагает, что проверки в различных звеньях фармацевтической цепочки создания стоимости являются критическим условием прекращения продажи фальсифицированных лекарств (Wondemagegnehu, 1995). Качество этих проверок зависит от адекватности финансирования регулирующих органов, которые должны иметь достаточное число тщательно отобранных, обученных и получающих достойную зарплату инспекторов. Необходима также ротация инспекторов, чтобы минимизировать возможность установления слишком близких отношений с производителем. Сотрудники таможни также должны иметь соответствующую подготовку в сфере выявления фальсифицированных продуктов.
Однако даже при таких проверках для выявления фальсифицированных или не соответствующих стандартам продуктов требуются сложные технические средства. Выборочное тестирование партий препаратов на различных этапах процесса является одним из методов. Другой метод – маркировка законно зарегистрированных фармацевтических препаратов простыми и недорогими метками подлинности, такими как штрихкоды и голограммы. Такие метки могут помочь широкой публике распознавать фальсифицированные продукты, о чем мы более подробно поговорим в следующем разделе.
Также важно привлекать фармацевтическую промышленность к решению проблемы фальсифицированных лекарств. Четырнадцать крупнейших исследовательских фармацевтических компаний создали с этой целью Институт фармацевтической безопасности. Через институт они следят за собственными продуктами в промышленно развитых странах, где на рынке встречаются фальсифицированные лекарства. Кроме отслеживания потоков продукции члены Института фармацевтической безопасности занимаются просвещением фармацевтов и других медицинских работников и распространяют информацию о фальсифицированных лекарствах среди потребителей. Многие ведущие фармацевтические компании отказываются продавать свою продукцию вторичным дистрибьюторам, если те не могут гарантировать законность всех своих поставщиков.
Международная фармацевтическая промышленность заботится о чистоте своей цепочки поставок и снижении репутационного риска путем предотвращения проникновения в нее фальсифицированных лекарств. Хотя штриховое кодирование и сканирование получили очень широкое распространение в последние 20 лет, ведущие производители лекарств быстро осваивают более совершенные технологии, такие как радиочастотные метки (RFID) и электронные коды продуктов (EPC) (пример 1.4). Преимущество новых технологий перед штрихкодами состоит в том, что в старых системах нужен персонал для «считывания» кодов, а новые системы считывают коды автоматически и хранят информацию в легко доступной форме. В случае RFID информацию можно легко прочитать и извлечь в любом месте через сеть, которая может охватывать несколько стран, облегчая производителям слежение и контроль за своей продукцией (включая условия хранения). Кроме того, с помощью этой системы оптовый или розничный продавец или даже таможенник может считать RFID-метку, чтобы проверить происхождение продукта и, следовательно, его законность и чистоту. Однако технология RFID сравнительно нова, и инфраструктура для ее поддержки, особенно на уровне розничной торговли и контроля, находится в процессе становления. Также существуют проблемы конфиденциальности, и технология не полностью защищена от неправильного использования (например, фальсификатор может заменить содержимое законной упаковки, имеющей RFID-метку, на подделку или фальсифицированный продукт). Помимо прочего, технология довольно дорога.
Пример 1.4. Использование ведущими производителями лекарств технологии RFID для обеспечения безопасности поставок
RFID-метка испускает слабый радиосигнал, который можно использовать для идентификации маркированной упаковки. Ведущие производители фармацевтической продукции все чаще используют RFID-метки в своих цепочках поставок, поскольку они позволяют создать электронную запись о происхождении и подтвердить подлинность продукта. Например, RFID-метку можно прикрепить на упаковку товара, когда он покидает фармацевтический завод. В каждой следующей точке цепочки поставок метку можно считать, чтобы проверить предыдущее место нахождения товара и характеристики и обновить информацию для следующего участника сети, который будет считывать ее. RFID-метки считываются с помощью специальных устройств без участия человека. Их чрезвычайно трудно подделать. С помощью RFID-меток также можно следить за такими характеристиками, как температура хранения продукта, а также узнавать об изменениях заранее определенного пути дистрибуции. Дистрибьюторы и фармацевты, имеющие соответствующую технологию, могут проверить электронную запись о происхождении, чтобы быть уверенными в законности и чистоте данного продукта.
Для сдерживания производства фальсифицированных или не соответствующих стандартам лекарств производителей, не соблюдающих стандарты, следует открыто называть поименно, штрафовать и порицать. Имена законопослушных производителей также должны быть известны, например, их можно публиковать на сайте фармацевтического агентства, чтобы помочь медицинским работникам и пациентам распознать производителей, выпускающих качественную продукцию.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Дворец Великих решений
Дворец Великих решений Черный цилиндр посреди зала, пульсирующий экран, у черных панелей роботы, оранжевые кресла — все, как и в первом сеансе, только теперь у кресел слева стоял Барбаросса. Блаженный покой охватил меня, мышцы расслабились, все дорогое для меня как бы
5. Принятие решений
5. Принятие решений Любое управление предполагает выработку и принятие разного рода решений. Управленческие решения являются существенными элементами планирования, организации, мотивации и контроля. В современной Японии подготовка и принятие решений образуют важный
3. Система принятия решений в СССР
3. Система принятия решений в СССР Политика Советского Союза, как и любого государства, представляет собой выполнение массы решений, принимаемых политическим руководством.Кто принимает политические решения в Советском Союзе? Конституция СССР, казалось бы, дает
Механизм принятия внешнеполитических решений
Механизм принятия внешнеполитических решений Российская Конституция предоставляет Президенту Российской Федерации право определять основные направления внешней и оборонной политики. Глава государства является главным дипломатом страны и Верховным
Мастера решений
Мастера решений Но для ЗС мало иметь «мозговой контур». Нужно еще уметь воплотить идеи в жизнь, выполнить планы, сформировать будущее. Поэтому есть и пятый контур ЗС — политические организации-оборотни, центры политических технологий.Их бытие и развитие неотделимы от
Пространство решений
Пространство решений Не в силах предугадать нюансов и частностей, мы, тем не менее, в силах разглядеть возможные стратегии выхода из Мегакризиса.Первый путь: создание цивилизации нового типа, что с помощью научно-технической и социальной революций снимет нынешние
Точка, точка, запятая
Точка, точка, запятая Литература Точка, точка, запятая СКАНДАЛЫ Коллегия Верховного суда РФ 14?июня должна поставить наконец в затянувшемся и, как сегодня говорят, резонансном «деле Международного литфонда» точку. Или снова запятую? На вопросы «ЛГ» отвечает Феликс
Виктор Алкснис НЕТ ПРОСТЫХ РЕШЕНИЙ
Виктор Алкснис НЕТ ПРОСТЫХ РЕШЕНИЙ Наиболее ярко и полно показывает ситуацию на любой территории то, с какими проблемами обращается население к своему депутату. По содержанию многочисленных писем, просьб и жалоб можно видеть, чем живет округ в целом. Ко мне тоже
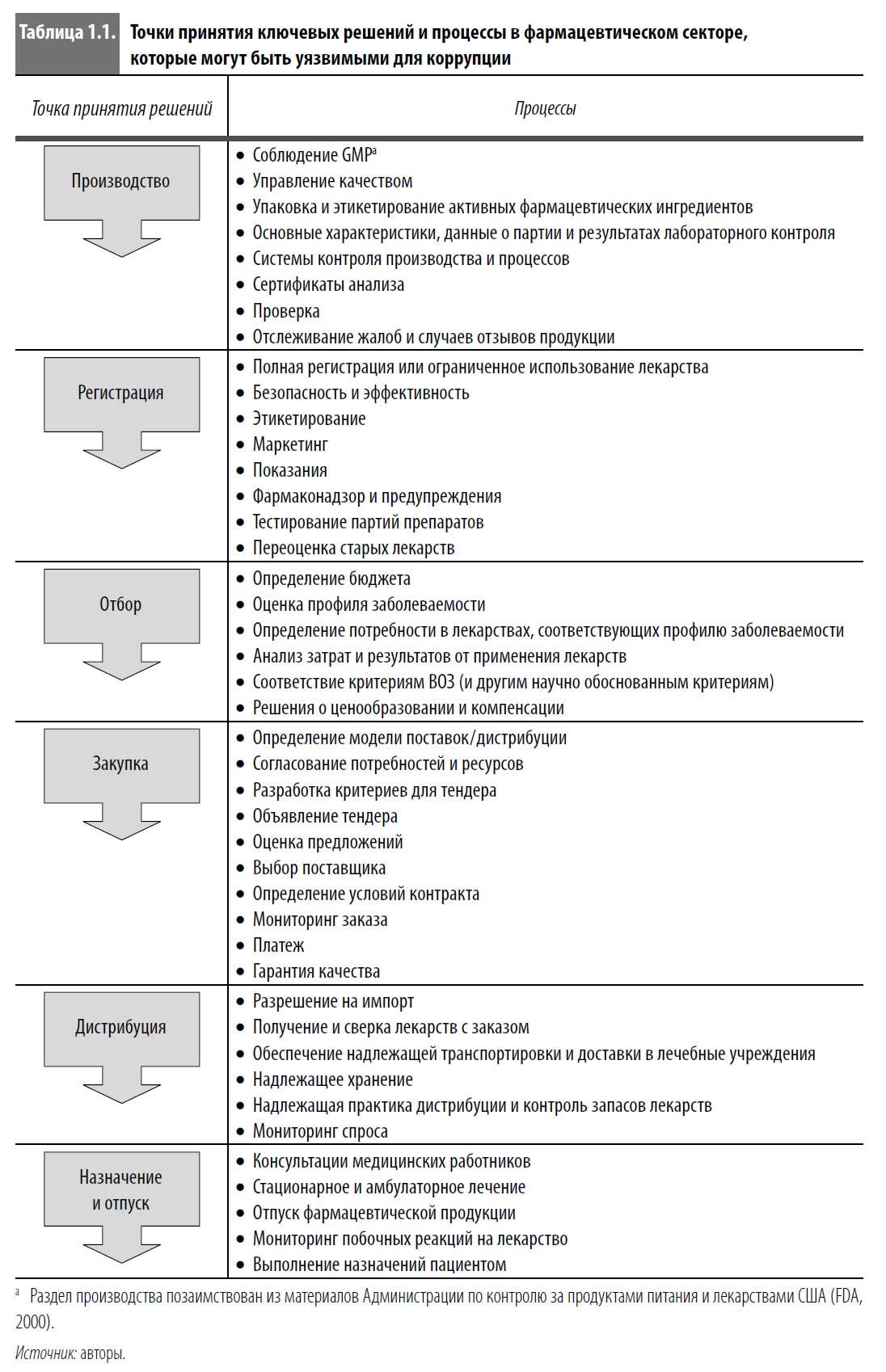
Анатомия коррупции: шесть точек принятия ключевых решений
Анатомия коррупции: шесть точек принятия ключевых решений Шесть основных областей фармацевтического сектора являются точками принятия ключевых решений и главными мишенями для коррупции: производство, регистрация, отбор, закупка, дистрибуция, назначение и отпуск (табл.
Точка принятия решений 2: регистрация и разрешение на продажу
Точка принятия решений 2: регистрация и разрешение на продажу Регистрация и разрешение на продажу лекарств были введены для защиты пациентов от инцидентов вроде трагедии 1950-х гг., когда неадекватное тестирование на безопасность препарата талидомид привело к рождению
Точка принятия решений 3: отбор
Точка принятия решений 3: отбор При отборе лекарственных средств, закупка которых финансируется государством, основная задача правительства – гарантировать честный и прозрачный выбор наиболее экономически приемлемых и подходящих для нужд здравоохранения лекарств с
Точка принятия решений 4: закупка
Точка принятия решений 4: закупка Цель закупок состоит в приобретении необходимого количества качественных лекарств по наиболее экономически приемлемой цене{41}. Функции правительства в этой точке принятия решений включают управление запасами, суммарные закупки,
Точка принятия решений 5: дистрибуция
Точка принятия решений 5: дистрибуция Государственная система распределения, независимо от того, кто ею управляет – правительственное агентство или частная компания по контракту с правительством, должна обеспечивать своевременную и безопасную поставку необходимого
Точка принятия решений 6: назначение и отпуск лекарств
Точка принятия решений 6: назначение и отпуск лекарств Назначение и отпуск лекарств происходит при участии врачей, фармацевтов, медсестер и других медицинских работников, которые ставят диагноз и определяют, какие лекарства следует принимать (если следует) пациенту для