Глава 3 Плохой контроль
Глава 3
Плохой контроль
Сертификация лекарств
Итак, вы затратили определенные усилия и средства на открытие молекулы, провели исследования, но этого еще недостаточно для того, чтобы ваше лекарство начали выписывать пациентам. Сначала вы должны обратиться в государственный контрольно-надзорный орган и получить сертификат на выпуск вашего препарата на рынок в пределах области, подконтрольной данному филиалу. Как и многое в медицине, эта сфера деятельности также хорошо скрыта от пристального общественного внимания благодаря сложной структуре процесса лицензирования, поэтому даже сами врачи порой не до конца понимают, чем именно занимаются государственные органы по надзору за распространением медикаментов. В качестве одного из примеров, иллюстрирующих этот факт, можно привести результаты опроса, проведенного в 2006 г. компанией IpsosMORI. Выяснилось, что 55 % врачей, работающих в больницах, и 37 % врачей общего профиля1 никогда не слышали о такой организации, как MHRA (Агентство по контролю за оборотом лекарств и медицинских товаров), — правительственном органе Великобритании, ответственном за оборот медикаментов в стране.2
В принципе работа такого контрольно-надзорного органа проста. В этом ведомстве выдают официальные лицензии на лекарства после того, как изучены результаты исследований, подтверждающие их эффективность; следят за безопасностью лекарств для людей после того, как препараты появляются на рынке, сообщают о рисках и опасностях врачам и изымают небезопасные и неэффективные препараты из оборота. К сожалению, как будет видно далее, контролирующие правительственные органы сталкиваются с рядом проблем, хоть в системе здравоохранения и есть люди, пытающиеся сделать все для блага пациентов. На государственные ведомства оказывают давление фармацевтические компании и правительство, они испытывают недостаток финансирования, сталкиваются с вопросами недостатка компетенции, в их стенах постоянно случаются конфликты интересов среди служащих госведомства, и, что самое плохое, все работники таких органов также одержимы пагубным стремлением сохранить все происходящее в отрасли здравоохранения в тайне.
Давление на госорганы
Социологи правительственных служб — а такие специалисты существуют — говорят о некоем явлении, которое получило название «переманивание госчиновников».3 Это когда чиновник правительственного надзорного агентства начинает действовать в интересах компаний, деятельность которых он должен контролировать, что неизбежно вредит интересам общества. Такая ситуация может произойти по ряду причин, и многие из них вполне объяснимы человеческой природой. Например, если вы работаете в такой нетворческой сфере бизнеса, как сертификация лекарств и надзор за фармакологическими препаратами, с кем вам можно будет перекинуться словечком о ваших каждодневных трудах и заботах? Беседовать с собственными коллегами как-то неудобно и уж слишком попахивает педантичностью, а вот сотрудники фармацевтических компаний из отделов по работе с правительственными агентствами по сертификации, с которыми вы связываетесь по долгу службы каждый день, те понимают, что к чему. Ведь у вас так много общего с ними. Так, подразделения компаний (и даже не обязательно сами фармацевтические компании) могут предложить ряд нематериальных выгод, таких как возможность завести полезные знакомства и посещать светские мероприятия.
Именно таким образом и происходит переманивание госчиновников, занимающихся сертификацией лекарств, в фармацевтические компании. Это явление вот уже на протяжении долгого времени находится в зоне пристального внимания как авторов научных трудов, так и тех, в чьи цели входит поиск путей воздействия на чиновников правительственных ведомств. Описание, обезоруживающее своей прямотой, которое раскрывает точку зрения компаний на это явление, можно найти в книге под названием «Игра с госорганами по сертификации лекарств: стратегическое управление административными процессами».
Для эффективного лоббирования необходимо установить тесные контакты на межличностном уровне между лоббистами и правительственными чиновниками. Для стратегии переманивания чрезвычайно важны светские общественные мероприятия. На них можно наладить долговременные личные отношения, которые могут перерасти в сотрудничество, неограниченное рамками какого-либо одного конкретного вопроса. Представители компаний и чиновники должны быть «нужными людьми» из ведомства, близкими к тем, кто принимает решения, а не просто функционерами, занимающимися организационными вопросами. Чиновник из госоргана по сертификации при принятии решения должен думать о том, какое влияние оно окажет на судьбы общества. У госслужащих будет гораздо меньше желания навредить своим давним хорошим знакомым, чем корпорациям. Конечно, при оказании давления на чиновников применяется также много важных тактических ходов. Наиболее эффективно идет лоббирование интересов фармацевтических компаний, если выявить ведущих экспертов в каждой конкретной сфере и нанять их в качестве консультантов или советников либо же дать им грант на проведение исследований, либо соблазнить их еще чем-то подобным. Деятельность такого рода требует проявления такта и деликатности, она не должна выставляться напоказ, так как сами эксперты, служащие правительства, не должны осознавать, что они становятся необъективными при принятии решений и ограниченными в свободе действий. Реализация подобной программы лоббирования по крайней мере снижает вероятность того, что ведущий эксперт начнет свидетельствовать на заседаниях или писать статьи, противоречащие интересам сертифицируемых компаний.4
Помимо этого существует перемещение сотрудников между правительственными агентствами по сертификации и фармацевтическими компаниями, своего рода шлюз, этакая вращающаяся дверь, создающая проблемы, которые очень сложно отслеживать и решать. Зарплата у правительственных чиновниках в госорганах по сертификации обычно низкая, и, проработав некоторое время, например, в Агентстве Великобритании по контролю за оборотом лекарств и медицинских товаров, чиновник начинает замечать, что люди из департамента сертификации лекарств компаний, с которыми он сотрудничает, его друзья, с которыми он встречается на светских мероприятиях, — все имеют машины куда более статусные, чем у служащих правительственных ведомств. Работники фармкомпаний живут в более респектабельных районах, а их дети ходят в более престижные школы. При этом и чиновник, и служащий такой компании занимаются по сути дела одной и той же работой, разница лишь в том, что они находятся по разные стороны забора. На самом же деле чиновник, как лицо, обладающее знаниями о внутреннем порядке и структуре работы правительственного контрольно-надзорного органа, считается ценным сотрудником для фармацевтической компании, особенно если в сфере его деятельности есть множество длинных, но непонятных правил, а советы типа «как можно избежать этого» или «как урвать кусок побольше» по традиции передаются в более действенной устной форме.
Такая текучка кадров далее создает еще одну проблему: что если чиновники, работающие в правительственном контрольно-надзорном органе, находясь на своих постах, видят себя в будущем в рядах работников фармацевтических компаний? В этом случае существует вероятность, что они будут неохотно принимать решения, которые могут поссорить их с потенциальным работодателем. Такой конфликт интересов очень сложно отслеживать и управлять им, так как на текущий момент регулирующего механизма, изложенного в декларативной форме, не существует. Также сложно предсказать, кто перейдет работать в фармацевтическую компанию, и вряд ли можно будет наложить санкции на таких людей после их увольнения из правительственных ведомств. Кроме того, если отдельные личности, работающие в государственном агентстве по контролю и надзору, и начинают корректировать свои действия, имея в голове смутные мысли перейти в фармкомпанию, такое отклонение в их поведении не обусловлено четким планом получения работы или подарков от производителей лекарств, поэтому трудно будет добыть убедительные доказательства, достаточные для обвинения их в коррупции. Ведь действия таких людей могут быть неосознанными. К тому же все крупные организации похожи на крупнотоннажные танкеры: им нужно некоторое время для того, чтобы изменить направление движения. Гораздо более вероятно заметить изменения в отношении работников к делу, постепенную смену приоритетов и неявные цели организации.
Ярким примером того, как к таким проблемам относятся в Европейском медицинском агентстве (ЕМА), может послужить случай, произошедший с самим главой этой организации. ЕМА контролирует ведение фармацевтической деятельности во всей Европе и выполняет обязанности контрольно-надзорных органов в отдельных странах, входящих в ассоциацию. В декабре 2010 г. в должность исполнительного директора вступил Томас Лоннгрен, а 28-го числа того же месяца он отправил письмо руководству совета ЕМА, в котором сообщал, что всего через 4 дня, с 1 января 2011 г., он начинает работать частным консультантом фармацевтических компаний.5
В некоторых странах в отраслях определенного рода есть четкие указания относительно подобного рода ситуаций. В США, например, нужно выждать год после увольнения из оборонного ведомства перед тем, как можно будет начать работать на компанию, входящую в ту же отрасль. Через 10 дней председатель ЕМА ответил Лоннгрену, что не имеет ничего против его намерений.6 Он не наложил на своего коллегу каких-либо ограничений и, что примечательно, даже не попросил Лоннгрена разъяснить, какого рода деятельностью собирается заниматься бывший сотрудник.7 Лоннгрен же сообщил в письме, что его будущая работа не будет входить в конфликт с интересами правительственного органа, и этого оказалось достаточно для всех вовлеченных в процесс лиц.
У меня больше вызывает беспокойство не сам поступок Томаса Лоннгрена, хотя я и полагаю, что все мы не испытали восторга по поводу хитрого маневра бывшего госслужащего. Ведь все мы, проживающие в Европе люди, в большей или меньшей степени можем считать себя его бывшими работодателями. На мой взгляд, случай с Лоннгреном представляет больший интерес с точки зрения того, что он может рассказать нам о ЕМА и об обычном отношении правительственного ведомства к проблемам подобного рода. Получается, что человек, который ранее контролировал процесс сертификации новых лекарств, теперь дает советы фармакологическим компаниям, как легче получить лицензию на тот или иной препарат. При этом он предупредил о своем намерении сменить род деятельности руководство ЕМА всего за 4 дня, в период между Рождеством и Новым годом, и ни один служащий ведомства не усмотрел в том никакого нарушения правил, а ведь данный случай является вопиющим конфликтом интересов. На самом деле ничего такого уж необычного в том нет: Европейская обсерватория по системам и политике здравоохранения недавно составила отчет, в котором было описано 15 подобных случаев, когда чиновники старшего звена из Европейского союза проходили через шлюз между правительственными организациями и фармацевтическими компаниями.8
Однако сотрудники государственного ведомства по сертификации лекарств не единственные, кому при работе приходится сталкиваться с конфликтом интересов (это понятие будет рассмотрено мною более подробно в главе 6). Многие из представителей по делам пациентов, которые заседают в совете Европейского медицинского агентства (ЕМА), включая двух членов, входящих в совет по управлению, пришли из организаций, интенсивно финансируемых фармацевтическими компаниями. Это противоречит правилам ЕМА, где говорится, что «члены руководящего совета не должны иметь финансовых или каких-либо других интересов в фармацевтической промышленности, которые могут повлиять на их беспристрастность».
В США на совещании Управления по контролю за качеством пищевых продуктов и лекарственных веществ, посвященном вопросу обезболивающих препаратов сомнительного действия из группы ингибиторов ЦОГ-2, таких как «Виокс» (Vioxx), 10 из 32 членов совета имели интересы, входящие в противоречие с интересами органа, и 9 из этих 10 проголосовали за то, чтобы оставить препараты на рынке, в то время как соотношение голосов «за» и «против» среди остальных членов комитета составило 60/40. Исследования результатов ряда голосований Управления по контролю за качеством пищевых продуктов и лекарственных веществ показали, что эксперты более склонны проголосовать в интересах фармацевтических компаний, если у чиновников есть какие-либо финансовые обязательства перед ними (хотя их исключение не повлияло бы на общий итог голосования изученных совещаний).9
Можно привести бесконечное число примеров, когда интересы сотрудников Управления по контролю за качеством пищевых продуктов и лекарственных веществ входят в противоречие или когда решение принималось под давлением политических факторов на членов совета органа. Я не думаю, что такие случаи представляют какой-либо интерес (но я рад, что находятся люди, документирующие их), так как их описание больше похоже на пересказ какой-то «мыльной оперы», что не имеет отношения к науке, однако существует проблема,10 и она далеко не нова. В 50-х годах американский сенатор Эстес Кефаувер провел ряд слушаний, посвященных деятельности Управления по контролю за качеством пищевых продуктов и лекарственных веществ. Он отметил, что некоторые препараты получали сертификат, несмотря на то что не оказывали какого-либо нового положительного эффекта. Наряду с многими другими изменениями он порекомендовал ввести лицензирование лекарственных препаратов с последующим тщательным перелицензированием уже после того, как они будут выпущены на рынок. Однако представители Управления встретили это предложение в штыки, а чиновники Управления здравоохранения все чаще жаловались на давление со стороны фармацевтических компаний. Одно из возможных объяснений такой странной ситуации лежит в раскрытых фактах подкупа должностных лиц: глава одного из подразделений получил 287000 долларов от фармацевтических компаний, что составляет более 2 млн долларов в пересчете на сегодняшние деньги.11
Сейчас чувство беспокойства в связи с необоснованно сдвинутыми приоритетами возникает при изучении анонимных опросов специалистов, работающих в государственных контрольно-исполнительных органах, хотя давление, которое они испытывают, имеет больше политическую природу, нежели финансовую. Организация с поэтическим названием «Союз обеспокоенных ученых» недавно провела опрос 1000 ученых, работающих на Управление по контролю за качеством пищевых продуктов и лекарственных веществ, во время которого 61 % респондентов заявили, что знают о случаях, когда сотрудники их ведомства из Департамента здравоохранения и соцобеспечения или те, что были назначены на должности в Управление по политическом мотивам, необоснованно вмешивались в действия госслужащих этого ведомства или оказывали влияние на действия организации. Пятая часть опрошенных заявила, что их самих «просили по причинам, не относящимся к науке, необоснованно удалить или внести изменения в какие-либо технические данные или переписать свои заключения, составленные для научного документа Управления по контролю за качеством пищевых продуктов и лекарственных веществ». Только 47 % респондентов считают, что Управление «регулярно доводит до сведения общественности достоверную информацию без купюр и опущений (в полном объеме)».12 Если вы сомневаетесь в компетентности специалистов команды, проводившей опрос, то спешу сообщить, что Департамент здравоохранения и соцобеспечения провел еще одно сходное исследование два года назад и снова пятая часть всех опрошенных заявила, что на них оказывалось давление при сертификации лекарства, несмотря на наличие сомнений относительно его эффективности и безопасности.13
Также есть свидетельства, поступившие от членов самих организаций. Во время изъятия с рынка препарата «Виокс» (Vioxx) в Управлении по контролю за качеством пищевых продуктов и лекарственных веществ приняли несколько спорных решений. Позднее Дэвид Грэхем, помощник директора по науке и медицине офиса по лекарственной безопасности, рассказал комитету финансов Сената США: «Управление по контролю за качеством пищевых продуктов и лекарственных веществ стало агентом, действующим в интересах фармакологических компаний. Я присутствовал на сотнях и тысячах совещаний, и как только компания говорит, что она не собирается предпринимать что-либо, Управление идет на попятный. Служащие Управления красноречиво называют фармакологические компании не иначе как „наши партнеры по бизнесу“».
На протяжении многих лет выдвигались различные предложения, как в госорганах можно решить проблему наличия экспертов со связями в фармакологической индустрии. Несомненным, конечно, является то, что их следует полностью исключить из процесса принятия решения, хоть это может привести к возникновению новых проблем: станет трудно найти специалистов, у которых не было бы подобного рода связей. И вовсе не потому, что представители академических кругов настолько погрязли в коррупции или все так охочи до денег, а от того, что на протяжении более чем двух десятилетий правительства стран всего мира интенсивно поощряли сотрудников университетов работать совместно с фармакологическими компаниями. По мнению государственных чиновников, такое взаимодействие должно было стать стимулом к прогрессу и снизить расходы на общественный сектор. Поскольку такая ситуация активно культивировалась, было бы странным, если бы теперь нам пришлось всерьез задуматься об исключении наших лучших ученых из числа людей, к которым можно обратиться за помощью при решении вопросов, касающихся эффективности и безопасности. Вопрос, однако, остается. Как мы можем отслеживать и сдерживать возникающий в таких условиях конфликт интересов?
Другое предложение — сделать членство и процедуру голосования на таких советах открытыми. В этом отношении Управление по контролю за качеством пищевых продуктов и лекарственных веществ ушло далеко вперед от ЕМА, где членство, голосование и выдача комментариев были тайными с самого начала, хотя за прошедшие годы стали заметны предпосылки к большей прозрачности (на основе уже прочитанного вами вам следует понимать, что не стоит принимать обещание ЕМА за чистую монету, а следует подождать и посмотреть, что произойдет на самом деле). Стоит отметить один момент: я не думаю, что такое нововведение изменит чье-то мнение относительно прозрачности внутри организации. Ведь есть один аргумент в пользу тайных совещаний с предоставлением анонимных комментариев: люди могут высказаться более честно, если уверены, что говорят не для протокола, неофициально.
«Я не должен вам говорить это, — скажет профессор перед аудиторией, которой он доверяет. — Но все в MGB знают, что это лекарство — полная дрянь, а результаты последнего исследования, не включенные в официальный отчет, также оставляют желать лучшего».
Есть и другие мотивы, заставляющие ведущих чиновников госорганов по сертификации лекарств сомневаться относительно того, кому следует хранить верность. До 2010 года, например, ЕМА заседало в Генеральном директорате по предпринимательству и промышленности Европейской комиссии, а не в Дирекции по здравоохранению, и это обстоятельство наводит на мысль, что политический вектор был больше направлен на получение экономической выгоды в размере 700 млрд долларов благодаря дружественным отношениям с фармацевтическими компаниями, чем на лоббирование интересов пациентов.14
И в США, и в Европейском союзе деятельность органов сертификации оплачивается почти полностью фармацевтическими компаниями из средств, которые выделяются на проведение сертификационных мероприятий и выполнение всех предписанных законом условий. До недавнего времени, пока сертификация не стала централизованной и проводимой только ЕМА, это обстоятельство вызывало определенного рода беспокойство в Европе, так как производители лекарств могли выбирать сами, в какой стране подать заявку на прохождение процедуры сертификации, что привело к возникновению чего-то вроде соревнования. В целом такой способ оплаты создавал впечатление, что компании — это клиенты, но не только потому, что они выписывали чеки. Такое изменение в финансировании ввели специально для сокращения сроков сертификации, идя навстречу пожеланиям фармакологических фирм.
Сертификация препарата
Теперь давайте определимся, что же имеют в виду госчиновники контрольно-регулирующих органов под словом «эффективный», когда оценивают положительные стороны нового препарата? Действие каждого препарата часто обсуждается на специально организованных для этой цели переговорах. Для специалистов, искушенных в мастерстве нечестной схватки за получение сертификата на препарат, знание внутренних правил госведомства и его неписаных традиций часто оказывается таким же ценным, как и знание официальных правил. Например, исследование показало, что заявки от больших компаний, у которых больше опыта при получении сертификата, проходят весь процесс быстрее, чем заявки от малых компаний. При этом от компании обычно требуется предоставить результаты двух или трех исследований, в которых принимали участие от тысячи пациентов и более, чтобы показать, что лекарство действительно эффективно.
Именно на этом этапе производители лекарств напускают больше всего тумана. Несмотря на то что идея и суть простого исследования с произвольной выборкой должны быть четко сформулированы, в действительности при проведении сравнений, оценке и измерении эффективности препарата имеют место всякого рода искажения и ложные толкования результатов. Лично для меня вопрос «Какое лекарство действенно?» является самым прямым и имеющим практическое значение для пациента, и он предполагает простой ответ. Больной хочет знать, как можно быстрее и эффективнее вылечить его болезнь.
Единственный способ получить ответ на этот вопрос — сравнить новое лекарство, появившееся на рынке, с лучшим имеющимся на текущий момент препаратом. Однако совсем не этого требуют от фармкомпаний органы по контролю за оборотом лекарственных средств, чтобы допустить новый препарат на рынок. Зачастую даже когда в наличие уже есть ряд эффективных лекарств, чиновники рады, если фармацевтическая компания всего лишь докажет, что новое лекарство лучше, чем ничего. Другими словами препарат должен быть лучше, чем лекарство-пустышка, плацебо, которое не содержит никакого действующего вещества, а производители рады, что планка оказалась такой низкой.
«Лучше, чем ничего»
Такой подход ведет к возникновению серьезных проблем, первая из которых этическая. Совершенно очевидно, что нельзя подвергать пациентов исследованиям, во время которых половине из них дается плацебо, тогда как на текущий момент есть доступный препарат, доказавший свою эффективность, поскольку в этом случае вы сознательно обрекаете половину ваших больных на страдания. Помните, что ваши подопытные не здоровые добровольцы, предоставившие свой организм для экспериментов в обмен на денежное вознаграждение. Вы имеете дело с настоящими пациентами, которые подчас серьезно больны и рассчитывают на избавление от мучений, подвергая себя некоторым неудобствам (при этом надеясь, что эти неудобства не перерастут во что-то более серьезное), и все для того, чтобы врачи расширили свои знания, необходимые для лечения других людей в будущем.
Более того, если пациенты участвуют в эксперименте, при котором используется плацебо вместо доступного на данный момент эффективного препарата, они страдают вдвойне. Есть очень большая вероятность, что авторы исследований, в которых они участвуют, не пытаются ответить на вопрос, имеющий смысл с точки зрения клинической практики и относящийся к врачебному делу как таковому. Ведь и доктора, и пациенты не просто хотят узнать, лучше ли новое средство, чем вообще ничего, если только речь не идет о какой-нибудь самой абстрактной и отвлеченной дисциплине. Мы заинтересованы в получении ответа на другой вопрос: лучше ли это лекарство того, что уже имеется на рынке на данный момент, а когда препарат сертифицирован, мы ожидаем, по крайней мере, увидеть результаты исследований, которые отвечают на поставленный вопрос.
Но совсем не то пациенты получают в действительности. В работе от 2011 г. были изучены данные, подтверждающие эффективность каждого из 197 новых лекарств, сертифицированных Управлением по контролю за качеством пищевых продуктов и лекарственных веществ между 2000 и 2010 гг., которые были предоставлены на момент согласования выпуска этих препаратов на рынок.15 Только 70 % всех средств имели информацию, подтверждающую, что эти лекарства более эффективны по сравнению с другими (и это если не учитывать препараты для лечения состояний, от которых на тот момент не было никаких лекарств). По целой трети препаратов отсутствовали данные сравнения с лучшими имеющимися на тот момент лекарствами, а ведь это единственный вопрос, который интересует пациентов.
Как видим, Хельсинкская декларация очень щепетильна в отношении защиты пациентов от ненужной опасности, которой они могут подвергнуться при проведении исследований. Серьезное ограничение на бесконтрольное использование плацебо было введено после поправки от 2000 г., где говорится, что:
…использование препаратов-плацебо приемлемо только при наличии веских оснований и обосновано исчерпывающими научными методическими причинами, такой препарат (плацебо) нужен для определения эффективности или безопасности вмешательства, а пациенты, получающие такие вещества, <…> не должны подвергаться риску получить серьезный или необратимый вред. Должны быть предприняты все меры предосторожности во избежание злоупотребления данным разрешением на использование плацебо.
Читателю будет интересно узнать, что принятие этой поправки обозначило начало процесса, благодаря которому Управление по контролю за качеством пищевых продуктов и лекарственных веществ открестилось от Хельсинкской декларации, отказавшись принять ее за основной документ, на который следует опираться при сертификации лекарств в особенности, если речь идет об исследованиях, проводимых за пределами США (как уже описывалось ранее в книге).16
Та же самая вопиющая проблема неравноценного сравнения препаратов существует и в Европейском союзе.17 При рассмотрении вопроса о выдаче лицензии на препарат для его выпуска на рынок ЕМА не требует от фармацевтических компаний доказательств того, что это лекарство является лучше, чем имеющееся на текущий момент средство, даже если оно используется повсеместно. Нужно всего лишь показать, что этот препарат лучше, чем отсутствие всякого лекарства. Исследование от 2007 г. показало, что только в половине случаев препараты, на которые были выданы сертификаты между 1999 и 2005 гг., сравнивались с другими лекарствами на момент выпуска их на рынок (со стыдом следует отметить, что были опубликованы и находятся в открытом доступе для врачей и пациентов результаты только одной трети таких исследований).18
Многие исследователи высказываются за интенсивное освещение проблемы подхода к лицензированию лекарств, которое проводится под девизом «Лучше, чем что-то», и призывают доводить ее суть до общественности как можно активнее.
В идеале в инструкции, которую пациенты получают в коробке с лекарством, должна стоять соответствующая отметка. Ведь выпуск инструкции к медикаментам — это единственный этап лицензирования лекарства и работы с компаниями, который государственные госорганы полностью контролируют. В одной из недавних статей была предложена простая формулировка: «Несмотря на то что было отмечено, что препарат снижает кровяное давление более эффективно, чем плацебо, не было предоставлено доказательств его большей эффективности по сравнению с другими лекарствами той же самой группы».19 Предложение было проигнорировано.
Косвенные или суррогатные эффекты
Контроль использования плацебо — не единственная проблема, возникающая при исследованиях, которые проводятся с целью получения маркетингового сертификата. Часто лекарства лицензируются, несмотря на то что исследования не подтвердили их прямого выраженного эффекта, направленного, к примеру, на купирование сердечного приступа или предотвращение смерти. Вместо этого выдается сертификат в связи с проявленными положительными косвенными или суррогатными эффектами, такими как улучшение биохимии крови, показатели которой очень слабо или лишь теоретически связаны с реальными страданиями и смертью, а именно их пациенты и хотят избежать.
Лучше всего прояснить ситуацию на примере. Статины — лекарства, которые снижают уровень холестерина, однако их принимают не для того, чтобы снизить этот показатель, отображающийся в данных анализа крови: эти препараты принимают, чтобы снизить риск сердечного приступа или смерти. Именно предотвращение сердечного приступа и снижение вероятности наступления смерти являются показаниями к назначению препарата, а снижение уровня холестерина — всего лишь косвенный эффект, возникающий в процессе действия лекарства, то есть нечто, что, как мы надеемся, сопровождает прямой эффект препарата. При этом между суррогатными и прямыми эффектами может не быть ярко выраженной связи, либо она может отсутствовать вовсе.
Часто есть обоснованная причина использовать косвенный эффект лекарства как показатель, подтверждающий наличие прямого действия лекарства, по крайней мере, применительно для некоторых данных. Люди умирают долго, и это одна из основных проблем при проведении исследований, прошу прощения за такую крамольную мысль. Поэтому если вы хотите получить ответ быстро, вы не можете ждать, сидя у постели пациента, пока у него случится приступ или наступит смерть. В таких обстоятельствах косвенный эффект от лекарства, проявляющийся в положительном влиянии на показатели биохимии крови, может считаться обоснованным для назначения такого препарата для предотвращения смерти в качестве временной меры. Однако вам все равно придется провести длительные исследования на определенном этапе, чтобы подтвердить вашу догадку о связи косвенного и прямого эффекта. К сожалению, компании, которые пока что являются крупнейшими спонсорами исследований лекарств, либо нацелены на получение прибыли в кратчайшие сроки, либо стремятся получить разрешение на допуск лекарства на рынок как можно скорее, либо хотят получить результаты до того, как срок действия принадлежащего им патента на лекарство закончится.
Это представляет собой большую проблему для пациентов, так как благоприятное действие лекарства на суррогатные точки клинической эффективности часто не говорит о наличии эффекта от препарата на конечные точки, то есть на саму болезнь. В действительности история медицины полна примеров, когда все оказывается совсем наоборот.
Пожалуй, самый показательный и известный случай произошел во время исследований лекарств против сердечной аритмии, во время которых было протестировано три препарата на предмет проверки возможности предотвращения внезапной смерти пациентов, находившихся в высокой группе риска, так как у них наблюдалось нарушение сердечного ритма.20 Лекарства предотвращали развитие аритмии, поэтому медики подумали, что они, должно быть, действенные. На препараты был выписан сертификат, и они были выпущены на рынок с предписанием назначать для снижения риска неожиданной смерти у пациентов, страдавших нарушением частоты сердечного ритма. И доктора не скупились выписывать их. Когда была проведена необходимая проверка с целью измерения количества смертей, исследователи почувствовали себя немного не в своей тарелке: препараты повышали риск смерти до такой неимоверной степени, что проверку было решено прекратить уже на начальной стадии. Оказывается, доктора щедро прописывали пациентам таблетки, которые убивали их. Было подсчитано, что от прописанных лекарств умерло более 100000 человек.
Даже если сами по себе препараты не повышают риск наступления смерти в значительной мере, иногда лекарства, которые облегчают симптомы, оказывая суррогатный эффект, просто никак не влияют на конечную точку клинической эффективности, в достижении которой заинтересован пациент, и поэтому не выполняют свое прямое назначение. Доксазозин — дорогой, качественный препарат для контроля кровяного давления. Он чрезвычайно эффективно снижает показатели по давлению в кабинете врача и действует почти так же хорошо, как и хлорталидон — простое, изобретенное много лет назад лекарство, используемое для снижения кровяного давления, срок действия патента на которое истек давным-давно. По прошествии некоторого времени была проведена проверка с целью сравнения прямых и суррогатных (сопутствующих), реально измеряемых эффектов этих двух препаратов, оказываемых на симптомы сердечной недостаточности. При исследовании использовались правительственные фонды, так как ни одна компания не имела финансовых интересов в проведении подобного рода изысканиях. Его пришлось прекратить на ранних стадиях, так как пациентам, принимавшим доксазозин, стало значительно хуже.21 Производитель доксазозина, компания P?zer, запустила грандиозную маркетинговую кампанию, поэтому едва ли были заметны какие-либо изменения в частоте использования этого препарата.22 Я опишу эту рекламную кампанию далее.
Можно привести много примеров лекарств, эффективность которых подтверждалось лишь на основе суррогатных эффектов. Пациент, страдающий диабетом, больше всего беспокоится о сохранении своей жизни. Он думает о том, как предотвратить возникновение различных осложнений: диабетической стопы, проблем с работой почек и ухудшением зрения и прочих сопутствующих недугов. Его беспокоит уровень сахара в крови и набор веса, так как это важные индикаторы того, что диабет находится под контролем. Однако все эти страхи ничто по сравнению с основным вопросом: какое из лекарств на самом деле снижает риск наступления смерти? Сегодня на рынке можно найти много новых лекарств разного рода от диабета. Рецепторные препараты класса глюкагоноподобный пептид-1, например, любят выписывать многие врачи. Если посмотреть на последний систематический обзор достоинств группы этих лекарств, опубликованный в декабре 2011 года (один из них просто оказался у меня под рукой — в нем могло бы быть указано любое количество препаратов), то можно увидеть, что эти препараты снижают уровень сахара в крови, кровяное давление, уровень холестерина, и все бы, казалось, хорошо,23 однако никто никогда не проверял, действительно ли они спасают людей от смерти, а ведь именно об этом думают больные, принимающие такие средства.
Все вышесказанное относится также и к побочным эффектам. «Депо-провера» (Depo-Provera) — сравнительно хороший контрацептив, однако есть опасения, что он повышает риск переломов. Исследования препарата были больше сконцентрированы вокруг определения плотности минерального состава кости, а не на оценке фактической возможности переломов.24 Когда фармацевтическая компания подает заявку на сертификацию лекарства для выпуска на рынок, госорганы, выдающие сертификат, часто разрешают фирмам предоставлять доказательства эффективности препаратов, базируясь только лишь на одной оценке суррогатных эффектов. Для ускоренной процедуры сертификации лекарств, считающихся первыми в новом классе препаратов либо использующихся для лечения недугов, для которых в настоящий момент нет никакого лечения, госорганы могут позволить фармацевтической компании ограничиться лишь оценкой суррогатных эффектов, пусть они и едва были подтверждены. Это означает, что были проведены лишь кратковременные исследования для выяснения, насколько хорошо лекарство влияет на снятие действительной причины болезни. В свете этого стоит помнить, что в приведенных выше примерах, где говорилось об искаженной информации, сбивающей пациентов с толку, речь шла о суррогатных эффектах, которые считаются «хорошо подтвержденными». Было бы неплохо, если бы выпуск лекарства на рынок был только началом истории, отмашкой, после которой разрешено начать осторожно прописывать лекарство, параллельно ведя более широкий мониторинг реальных полезных эффектов препарата. К сожалению, как вы скоро сами убедитесь, все обстоит совсем не так.
Ускоренная сертификация
На сбор и оценку фактов, подтверждающих эффективность лекарств, во время исследования уходит много времени, но госорганам по контролю и сертификации медикаментов приходится лавировать между несколькими противодействующими силами. Работники здравоохранения, следящие за общественным здоровьем, часто склонны тщательно проверять, было ли предоставлено достаточное количество качественных материалов, подтверждающих эффективность нового продукта. Отчасти потому, что многие новые лекарства очень похожи по действию на те, что уже имеются в наличии, и лишены новизны, а также потому, что период предварительной сертификации — это время, когда требования, предъявляемые к проведению фармацевтическими компаниями обязательных исследований, чаще всего выполняются ими в полной мере.
Сами компании-производители лекарств тем временем хотят выпустить препарат на рынок как можно быстрее и затратить на это как можно меньше средств. Дело не только в желании поскорее начать получать прибыль, но и в страхе потерять какую-то ее часть. Ведь часы уже запущены, срок действия патента неуклонно начитает сокращаться еще до того, как начинается процесс сертификации. О преимуществах получения коммерческой выгоды сообщают в недвусмысленной форме правительству, которое подстегивает контролирующие органы, требуя побыстрее выдать сертификат, и часто для высшего руководства эффективность работы ведомства измеряется скоростью выпуска того или иного документа.
Последствия такого подхода, прямо скажем, вызывают беспокойство. Такое отношение наводит на мысль, что качество предоставленных данных, подтверждающих действенность препарата, — не единственный фактор, влияющий на выдачу сертификата. На протяжении десятилетий, например, оценка деятельности Управления по контролю за качеством пищевых продуктов и лекарственных веществ измерялась тем, сколько препаратов было лицензировано организацией в каждом календарном году.25 Это привело к возникновению такого явления, которое получило название «эффект декабря», когда большая часть сертификатов выдавалась чиновниками соответствующих госорганов впопыхах в течение последних нескольких недель перед Рождеством. Если составить график выдачи сертификатов, выданных в декабре каждого года в течение 30 лет (см. ниже, Карпентер, 2010 г.), можно увидеть масштаб, который приняло это явление, а также отследить период еще более лояльного отношения к фармацевтическим компаниям, наступивший во времена правления президента Рональда Рейгана (1981–1989 гг.) Если бы выдача сертификатов была сбалансирована на протяжении всего года, было бы видно, что каждый месяц выдается только по 8 % от числа всех лицензий. В конце 80-х пропорция их выдачи в декабре выросла более чем на половину, и трудно поверить, что нужные разрешения выдавались сразу после того, как оценка препаратов только-только заканчивалась.
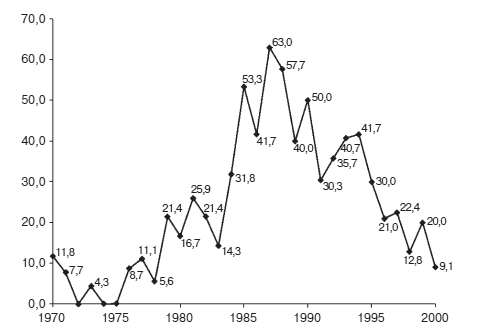
Данные по выдаче сертификатов на новые молекулярные соединения (%) в декабре 1970–2000 гг.
О наличии этой неблагоприятной тенденции свидетельствует также то, что продолжительность периода сертификации препаратов значительно сократилась по всему миру: в США количество дней, в течение которых получалась лицензия, с 1993 года уменьшилось наполовину (до этого сроки также неоднократно урезались), а в Великобритании период рассмотрения сократился еще больше — с 154 рабочих дней в 1989 году до 44 дней десятью годами позже.
Было бы ошибочно думать, что представители фармацевтических компаний — единственные люди, кто оказывает давление на контролирующие госорганы с целью ускорения процесса выдачи сертификата. У пациентов тоже иногда создается впечатление, что их лишают доступа к лекарствам, тем более, когда они находятся в безвыходном положении. Так, например, в 80-х и 90-х годах основная сила, влияющая на решения госведомств по контролю за медикаментами, исходила от союза, созданного компаниями и активистами из числа больных СПИДом, таких как члены группы «Действуй!».
Это было время, когда ВИЧ и СПИД появились словно бы из ниоткуда, и молодые, здоровые гомосексуалисты начали заражаться опасным вирусом и умирать сотнями, в то время как лечения от болезни не было. «Нам плевать! — заявляли они. — Нам все равно, если препараты, эффективность которых еще не проверена, могут убить нас. Мы хотим принимать эти лекарства. Ведь мы все равно умираем». Потерять несколько месяцев жизни из-за того, что непроверенный на текущий момент препарат оказался опасным, ничто по сравнению с попыткой спасти свою жизнь. В преувеличенной и утрированной форме активисты сообщества ВИЧ-инфицированных приводили пример лучшего стимула, который заставлял людей соглашаться на участие в клинических исследованиях. Они были готовы пойти на риск в надежде на то, что для них или хотя бы для их товарищей в будущем создадут хоть какое-то лекарство. Для достижения поставленной цели они блокировали уличное движение на Уолл-Стрит, устраивали марши на площади перед штаб-квартирой Управления по контролю за качеством пищевых продуктов и лекарственных веществ в Роквилле (штат Мэриленд) и неустанно организовывали различные кампании, направленные на ускорение выдачи сертификатов на необходимые им лекарства.
В результате этой кампании был введен ряд постановлений, позволивших проводить ускоренную процедуру сертификации для некоторых новых лекарств. Данное законодательство должно было применяться, когда речь шла о лекарствах, решающих вопросы жизни и смерти, в ситуациях, когда другого доступного препарата на тот момент не существовало. С момента принятия нового акта прошло уже 10 лет, но, к сожалению, как можно увидеть, его требования применяются к совсем другим случаям.
Мидодрин
После того как лекарство сертифицировано, очень редко случается ситуация, когда госорганы решают изъять его с рынка, особенно если речь идет всего лишь об отсутствии эффективности лекарства, а не о высокой смертности пациентов в результате вызываемых им побочных эффектов. Но даже если изъятие какого-либо препарата и происходит, госорганы удаляют его с рынка с огромной задержкой.
Мидодрин — препарат, используемый для лечения ортостатического коллапса, состояния, при котором падение кровяного давления вызывает у человека головокружение, когда тот пытается встать.26 Хоть такое состояние, несомненно, вызывает определенного рода дискомфорт у пациентов, страдающих этим недугом (во время приступа пациенты подвергаются повышенному риску, так сказать, потерять равновесие и упасть, у них кружится голова), оно все же не входит в число болезней, которые принято считать серьезными или представляющими угрозу для жизни человека. Более того, серьезность недуга и его место в ряду отдельных медицинских заболеваний варьируются в зависимости от страны и принадлежности пациента к культурному слою. Однако ввиду того, что ранее не было никаких лекарств для лечения данной болезни, в 1996 году стало возможно провести мидодрин по ускоренной схеме сертификации лекарственных препаратов с предоставлением слабых подтверждающих данных, заручившись предварительно обещанием компании провести позднее дополнительные исследования.
По сути дела мидодрин был сертифицирован на основе результатов трех незначительных и кратковременных исследований (два из них длились всего два дня), при которых многие люди, принимающие данный препарат, выбывали из процесса навсегда. Результаты проведенного исследования показали, что косвенная эффективность препарата была низкой (он слабо влиял на изменение кровяного давления, когда пациенты вставали), выраженного действия на конечную цель — устранение головокружения, улучшение качества жизни, отсутствие обмороков и т. п. — зафиксировано вообще не было. Вследствие этого, когда мидодрин был сертифицирован по ускоренной программе, производителю, компании Shire, пришлось пообещать провести дополнительные исследования после выпуска лекарства на рынок.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Не про «плохой совок»
Не про «плохой совок» Мне всегда думалось, что книги эти не про «плохой совок», а про трагическую историю нашего народа. Казалось бы, кому, как не патриотам их уважать и ценить, ведь они про реальный героизм, про силу духа людей, которые оставались живыми и выполняли свой
Борьба за действенность и ее составляющие. Контроль газеты и контроль читателей над тем, что в жизни требует исправления. «Хорошее настроение людей — надежный двигатель технического прогресса» — помогает ли этому девизу повседневный труд журналистов
Борьба за действенность и ее составляющие. Контроль газеты и контроль читателей над тем, что в жизни требует исправления. «Хорошее настроение людей — надежный двигатель технического прогресса» — помогает ли этому девизу повседневный труд журналистов — Я вижу, с
XII. Плохой год
XII. Плохой год И вот Олимпиада вновь увидела Эпир своего детства, тяжеловесный дворец отцов и храм Амона в Додоне, где посвященным было дано расслышать пророчества в голосе ветра, дующего среди вековых дубов.Двадцать лет пролетели с тех пор, как она покинула этот лес, чтобы
12. «Плохой» Адриан
12. «Плохой» Адриан В основном, жизнеописание Адриана выдержано в весьма положительных тонах. Однако в конце рассказа Элия Спартиана неожиданно вспыхивает тема «жестокого и плохого» Адриана. Хотя этот фрагмент невелик, он сильно контрастирует с остальным текстом. Мы
3. «Плохой» Коммод
3. «Плохой» Коммод Поздние комментаторы вылили на Коммода-Христа много грязи. Мы не будем углубляться в подробности, а ограничимся лишь несколькими, но яркими примерами, показывающими сильное раздражение, которое вызывал у части знати и царь-градцев император
Плохой студент?
Плохой студент? На третьем курсе физического факультета Московского университета каждый год проходит распределение студентов по различным специальностям: одни идут на кафедру физики твердого тела, другие — на кафедру теоретической физики, третьи решают посвятить себя
Глава 8 Тотальный контроль над всем устройством
Глава 8 Тотальный контроль над всем устройством «Я всегда хотел обладать первостепенными технологиями во всем, что мы делаем». Стив Джобс В 1984 году детище Джобса, первый компьютер «Макинтош», не имело внутреннего вентилятора охлаждения. Звук вентилятора сводил Джобса с
Глава IV Миф о «революции управляющих». Война за контроль над корпорациями
Глава IV Миф о «революции управляющих». Война за контроль над корпорациями Как известно, в XIX в. у крупных русских помещиков сложилась практика передавать управление своими обширными имениями наемным управляющим, чаще всего немцам. Но никто не догадывался в те времена
Глава 15. Глобальный контроль
Глава 15. Глобальный контроль Что касается более высокой степени контроля и манипуляций Нового Мирового Порядка, то многие слышали о печально известном Филадельфийском эксперименте. Некоторые также знают о проекте Феникс и ужасающих экспериментах, которые проводились в
Глава 43 Контроль над информацией
Глава 43 Контроль над информацией Баварские Иллюминаты начали — уже ко времени французской революции — распространять свою пропаганду в читательских клубах для того, чтобы склонять мнения читателей в свою сторону. Позднее, на всем протяжении 19-го столетия, когда
Глава 1. Мир охвачен сетевыми войнами Абсолютный контроль над всеми участниками исторического процесса вполне достижим
Глава 1. Мир охвачен сетевыми войнами Абсолютный контроль над всеми участниками исторического процесса вполне достижим Сетевое общество и его враги О сетях сегодня написано много книг. Есть технологические руководства по развитию торговых сетей, есть руководства для
КОНТРОЛЬ СВЕРХУ И КОНТРОЛЬ СНИЗУ В ДЕЛЕ ДОШКОЛЬНОГО ВОСПИТАНИЯ
КОНТРОЛЬ СВЕРХУ И КОНТРОЛЬ СНИЗУ В ДЕЛЕ ДОШКОЛЬНОГО ВОСПИТАНИЯ Двадцатилетие Великой Октябрьской революции мы встретили не только демонстрациями, торжественными заседаниями, мы встретили его делом — новой Конституцией СССР, которая поднимает советский,
Глава IV Контроль над информацией
Глава IV Контроль над информацией Самое обидное, что в информационной войне всегда проигрывает тот, кто говорит правду. Он ограничен правдой, лжец может нести, что угодно. Роберт Шекли Правивший Францией в XVII веке Людовик XIV скромно заметил как-то: «Государство — это я».
Глава 12. Расизм, контроль над рождаемостью и право на деторождение
Глава 12. Расизм, контроль над рождаемостью и право на деторождение Когда феминистки XIX века выдвинули требование «добровольного материнства», началась кампания за контроль над рождаемостью. Ее сторонников называли радикалами и подвергали такому же осмеянию, какое